| ■大隅グループ embryo チーム |
■大隅グループ adult brain チーム |
■若松グループ |
|
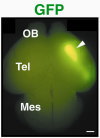
大隅教授グループ embryo チームでは、哺乳類の脳形成において以下のようなテーマで研究を進めています。 我々ヒトの脳には千億を超える神経細胞(ニューロン)が存在し、複雑な神経回路が形成されています。もとをただせば、非常に複雑な構造をもつ脳は神経板という外胚葉性のシート状の構造物に由来します。発生が進むと決められた位置に決められた数の必要なニューロンが形成されます。脳は無意識レベルの作用の制御を行うだけでなく、感情や記憶、学習、創造といったいわゆる高次機能をも制御している重要な器官です。我々は、どのようにして脳の領域が決定され、各領域特異的な脳の分化が起きるのかについて興味をもっており、脳形成の遺伝的プログラムを知りたいと考えています。現在大隅研究室では下記のような視点から哺乳類脳形成にアプローチしています。  細胞周期の調和のメカニズム
Pax6は発生期脳で領域特異的に発現し、脳のパターン形成、ニューロン分化および神経路形成に影響を与えていることが、ミュータントの表現型から示唆されています(図2, Osumi et al., 1997; Kawano et al., 1999)。
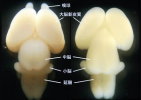
たとえば、Pax6は菱脳・脊髄では腹側に発現しており、Pax6変異ラット胚では運動ニューロンや腹側介在ニューロンの分化異常が認められ、Pax6がWnt signal を制御する可能性を見出しました(Osumi et al., 1997)。さらに、Pax6の下流でどのような因子が働くことにより神経管腹側における神経細胞サブタイプが決定されるかについて解析し、ホメオドメインコードと呼ばれる、異なる種類の細胞を生み出すための遺伝子の発現領域がPax6 変異ラットにおいて変化し、Pax6は神経管の領域化(ドメイン形成)とニューロンの特異化に関わることを、胎児脳への遺伝子導入系(下記参照)を用い、ミュータントの救済実験および野生型への強制発現実験 (Osumi & Inoue, 2001; Takahashi & Osumi, 2002、方法については下記別項を参照) などを行うことによって明らかにしました(図3, Takahashi et al., 2002)。 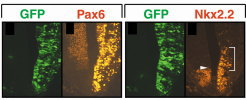 【図3】Pax6-EnRの導入によるPax6の機能解析 導入された右側においてNkx2.2の発現領域が拡大し、Pax6変異ラットと同様の表現型が見られた。 また、Pax6 は細胞接着に関わるカドヘリンなどの細胞接着分子を制御することも知られており、マウス初期神経板において、Pax6が細胞接着分子カドヘリン6の発現を制御することによって、未分化な神経上皮細胞の移動の制限に関わる可能性を指摘しています (Inoue at al., 2000)。このようなことから、脳の区画やドメイン形成における細胞レベルの現象に注目し、発現パターンが知られていないカドヘリン遺伝子について探索を行い(Takahashi & Osumi, 2005)、現在それらのいくつかについて、特に菱脳において、Pax6との関係について調べています。 嗅球は嗅覚系の一次中枢として機能する脳の重要な領域の一つです。嗅球は終脳の先端部分に突出した構造として形成されます。ところがPax6の変異マウス及びラットでは、嗅球の位置が異常であり、嗅球が終脳側面に存在することが判っています(図4)(Hirata et al. 2002)。培養系での細胞標識実験の結果、この嗅球の位置異常は神経細胞の移動様式の異常が原因であることをつきとめました。こでまでに細胞移植や遺伝子導入の技術を用いて、嗅球の発生におけるPax6の役割を明らかにしています(Nomura and Osumi, 2004) 。 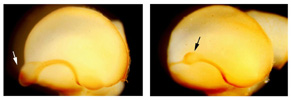 【図4】Pax6機能欠損マウスにおける嗅球の位置異常。 正常なマウスとPax6 変異マウスの終脳を側面から見たもので、正常なマウスでは嗅球が終脳の前端部に形成されるが(A 矢印)、Pax6変異 マウスでは嗅球様構造が終脳の側面に存在する(B 矢印)。 例えば大脳皮質であればradial migrationにより層構造が形成されるのに対し、その腹側では大脳基底核と呼ばれるような核構造が形成されます。また嗅球のニューロンは側脳室で生まれ、吻側に向かってかなりの距離を移動し、これは成体まで続きます。このようなニューロンの移動にどのような分子が関わっているかについては、例えばPS-NCAMや最近ではslitなどの分子の関与が指摘されていますが、まだほとんど分かっていません。これまでの解析から、Pax6変異マウス・ラットでは、大脳皮質、嗅球他での細胞移動の異常が見つかっています。胚発生時に終脳脳室帯で産生された神経細胞は終脳の表層へと移動しますが、一部の神経細胞は終脳の表面を水平方向に移動します(図5)。この水平方向の神経細胞移動は将来の大脳皮質の構築に重要な役割を果たしています。
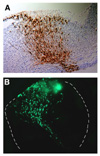
さらに我々はPax6変異体において、特に将来の嗅皮質に向かって背側から移動する神経細胞移動パターンが乱れていることを発見しました(図6, Nomura et al., 2006)。これらの神経細胞は上述のlot細胞よりも若干早い時期に移動してくるものです。これまでの解析によって、終脳嗅皮質の細胞構成がPax6 変異体では乱れていることがわかっていたので(Hirata et al. 2002)、この細胞移動パターンの異常との関係に注目しました。またこの事実は、神経細胞の移動を制御する分子がPax6によって制御されていることを示唆しています。そこでさらに解析を進め、Pax6がEphrinA5と呼ばれる、反発性の活性を持つ分子の発現を制御することで、神経細胞の移動パターンを制御することを明らかにしました。この表現型はEphrinA5のKO マウスにおいても同様に観察されました(Nomura et al., 2006)。 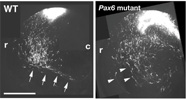 【図6】Pax6機能欠損ラットにおける神経細胞移動の異常 正常なラット(左)とPax6 変異ラットの終脳背側で生まれる神経細胞をを全胚培養系と電気穿孔法によりGFP発現ベクターを導入することにより標識し、細胞の移動パターンを解析した。側面から見たもので、正常なラットでは神経細胞は腹側領域に侵入しないが(左 矢印)、Pax6変異 ラットでは腹側領域に侵入してしまう(右 矢印)。 ヒトを含め脳は非常に複雑な情報処理器官であり、さまざまな種類の神経細胞やグリア細胞がも互いに連絡することにより、このような機能が発揮されています。神経細胞がどこで生まれ、移動し正確な神経回路を形成するか、それらのメカニズムの解明は神経発生学において重要な課題です。前述のように神経細胞の移動メカニズムの解明とともに、私たちは神経細胞が生み出される過程において、それらの親細胞となる神経上皮細胞(図7) がいかにして、未分化性を維持しつつ、ある決まった時期に神経細胞を生み出すのか、そのメカニズムを解き明かしたいと考えています。
神経上皮細胞は、脳室面側末端においてカドヘリンによる接着結合をつくり、お互いが細胞接着により維持されています。また、反対側の基底膜側末端には、インテグリンなどの接着分子が基底膜を構成する細胞外基質と結合し、安定な構造をつくっていると考えられています。興味深いことに、神経上皮細胞はエレベーター運動と呼ばれる核の移動運動を行っており、この動きは細胞のもつ細胞周期のリズムと連動しています(図8および次項目も参照)。脳の初期発生段階においては、将来莫大な数の神経細胞を作り出すための準備段階として、神経上皮細胞はエレベーター運動をしながら、自己複製する能力をもつ幹細胞を作り出しています。このような時期は、対称分裂のパターンがほとんどです。しかしながら、分泌性因子による刺激や、細胞の自律的な作用により、細胞の分裂パターンに変化が生じ、分裂後の細胞の片方が細胞周期をはずれ、神経細胞になるような場合が増えてきます。一方で、片方の細胞は再び細胞周期に入ることで、幹細胞の性質を維持しており、未分化性の維持または細胞増殖と神経細胞の分化のバランスが巧妙に制御されています。細胞分裂を終え、神経細胞にならなかった細胞は、次の分裂で神経細胞を生み出すことが考えられ、このような細胞は神経前駆細胞と呼ばれています。 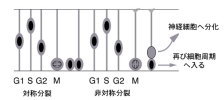 【図8】神経上皮細胞のエレベーター運動と細胞周期との関係 Pax6の変異動物では、細胞の増殖が亢進したり、一方で神経の分化が本来の時期より、早く起こるなどの報告があり、現在私たちは、時期依存的、場所依存的にPax6が細胞増殖および分化において果たす様々な役割について、解析を進めています。たとえば、後述のマイクロアレイによるPax6の下流遺伝子の探索により同定したFabp7 遺伝子は、Pax6の制御下において神経上皮細胞の未分化性の維持に寄与していることを、RNAiの手法により明らかにしています(図9, Arai et al., 2005)。 bHLH(basic helix loop helix)型転写制御因子をはじめとする様々な転写制御因子やNotch-Delta シグナル伝達経路による細胞間の相互作用および、RNA結合タンパク質や細胞接着装置などが、神経上皮細胞の未分化性の維持、細胞増殖および細胞分化を制御することがわかってきましたが、これらの遺伝子の作用により、細胞周期を調節する分子が制御されていることが明らかになってきています。たとえば、細胞の増殖はサイクリンとサイクリン依存性キナーゼ複合体の活性により促進され、いっぽうで、サイクリン依存性キナーゼインビターがこの複合体へ作用することで、細胞周期から逸脱し、分化すると考えられます。そこで私たちは、従来、培養細胞やがんの研究から明らかになってきた細胞増殖の機構を踏まえ、哺乳類神経発生における、エレベーター運動と細胞周期調節因子の活性の調節機構における関連性についても研究を進めています。 細胞周期の調和のメカニズム 発生中の中枢神経系(網膜を含む)では、多種類のニューロンとグリアを産み出す神経前駆細胞は「神経上皮」と呼ばれる神経管の内腔の層に存在しています。Pax6はその中で領域特異的に発現しており、上記とも関連しますが、多種類のニューロンを領域特異的に分化させることに関わっています。成体脳では神経上皮は「上衣層」という構造になりますが、実はこの部分は大人でも幹細胞が存在するところになっています。そして、まさにこの「上衣層」でPax6は発現しているのです。幹細胞に共通な特質としては「自己複製能」と「多分化能」ということがありますが、実は中枢神経系の神経幹細胞のin vivoの状態、すなわち「神経上皮」では、これに加えて「核のエレベーター運動」という現象が見られます「神経上皮」という構造は「偽重層上皮」といって、先端側(脳室側)から基底膜側(脳表面側)まで一続きの細長い細胞が集合した状態になっていて、細胞周期にしたがって、分裂期の細胞核は先端側に、DNA合成期の細胞の核は基底膜側に存在しているのです。これは、1960年代に藤田先生が発見されたことなのですが、どのようにして細胞周期とエレベーター運動(すなわち核の移動)が調和がとれているのかは謎のままでした。 最近、イギリスのグループがPax6変異マウスの大脳皮質原基では、分裂期の細胞が先端側以外に高頻度で見られることを報告しました。つまり、Pax6の機能が欠失したことにより、細胞周期と核移動の調和が乱されてしまうのです。この事実をもとに、これから細胞の挙動をモニターする方法で、細胞周期と核移動の調和のメカニズムについて解析しました(Tamai et al., 2006)。Pax6 変異体ラットの大脳皮質細胞原基神経上皮細胞の中心体が非常に不安定になり基底膜方向へ移動してしまうことと見出しました。このことから、Pax6は中心体の安定化を制御し、エレベータ運動を制御する可能性が示唆されました。 上記のように転写因子であるPax6はそれぞれ興味深い現象に関わる重要な因子です。転写因子はいわば命令を下す分子で、当然のことながら、さまざまな細胞現象が生じる為には、その下で働く実行部隊が多数必要です。そこで、マイクロアレイ法によって、Pax6変異ラット脳と野生型ラット脳の間で発現の異なる遺伝子を網羅的に探索し、標的遺伝子としてFabp7遺伝子を同定しました(図8, Arai et al., 2005)。これまでの研究から、Pax6は発現する場所、発生段階において異なる機能を持つ可能性が考えられることから、より早い時期やより遅い時期の異なる脳領域をもとに、マイクロアレイ解析を現在行っています。さらに、Pax6の標的遺伝子の制御領域について、細胞および個体を用いたレポーターアッセイを行っています。  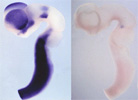 【図9】マイクロアレイ解析によるPa6標的遺伝子の同定とFabp7の発現パターン Fabp7遺伝子はPax6と類似した発現パターンを示し、Pa6変異ラット胚では発現が消失している。 私たちの研究では、大隅が得意としてきた哺乳類の全胚培養法(図10, Osumi 総説を参照)とelectroporationを組み合わせて、発生中期の胎児脳への効率の良い遺伝子導入の系を確立しました(Inoue et al.,2001; Osumi & Inoue,2001)。
この方法によって、RNA結合タンパク質遺伝子の導入による機能解析(Akamatsu et al., 1999)を行ったあと、Pax6をはじめとする転写因子(Takahashi & Osumi, 2002; Takahashi et al., 2002;Nomura and Osumi, 2004)や、cadherin(Inoue et al.,2001)やEphrin(Nomura et al., 2006)などの細胞膜結合分子の機能解析に応用され、、さらにはRNA干渉法により脂肪酸結合タンパク質の機能阻害実験(Arai et al., 2006) においても有効であること確かめられました。上記のマイクロアレイ解析で明らかになってきたPax6の標的候補遺伝子の機能解析などにこの方法を適用し、現在さまざまな遺伝子カスケードや遺伝子間相互作用を明らかにしようとしています。 また全胚培養ができない後期の胎児脳へのアプローチとして、電気穿孔法を子宮内手術法へ応用した系を確立しました(Takahashi et al., 2002)。この系は今後さまざまな方面に応用されることと思います(Nomura & Osumi, 2007)。
また最近では、電気穿孔法による遺伝子導入行い、蛍光タンパク質により標識した脳からスライスを作製し、顕微鏡下の培養により神経上皮細胞の増殖や分化、神経細胞の移動の実際の様子や細胞内分子の局在変化を生きたままに近い状態で観察する手法の開発にも取り組んでいます(Takahashi & Osumi, 2007)。 |
|
|
|
| ▲ページの上へ▲ |
|